
Кристаллизация и плавление веществ – это процессы, обусловленные изменением температуры. Для каждого вещества существует определенная температура, при которой оно переходит из жидкого состояния в твердое или наоборот. Но что приводит к таким изменениям? Существует несколько причин, объясняющих феномены кристаллизации и плавления. Рассмотрим их подробнее.
Одной из основных причин кристаллизации и плавления веществ является сила притяжения между их молекулами. В твердом состоянии молекулы располагаются в регулярном и упорядоченном сетчатом строении, образуя кристаллическую решетку. При этом между молекулами существуют силы притяжения, которые удерживают их в закрепленном положении. При нагревании вещество получает энергию, и молекулы начинают движение, преодолевая силы притяжения. Это приводит к растрескиванию кристаллической решетки и переходу вещества в жидкое состояние – процессу, называемому плавлением.
Обратный процесс – кристаллизация – происходит при охлаждении расплава или раствора. При этом молекулы медленно перемещаются и начинают встраиваться в кристаллическую структуру, образуя опять же упорядоченную решетку. Это происходит за счет восстановления сил притяжения между молекулами. Таким образом, при достижении определенной температуры – точки плавления – вещество начинает кристаллизоваться, превращаясь из жидкого в твердое состояние.
Причины кристаллизации и плавления

Кристаллизация и плавление веществ происходят под влиянием различных факторов. Одним из основных факторов является температура. Когда температура достигает определенного значения, которое называется температурой плавления, вещество начинает плавиться и переходит в жидкое состояние. Температура кристаллизации, напротив, определяется температурой, при которой жидкое вещество становится твердым. Таким образом, для каждого вещества существуют свои уникальные значения температуры плавления и кристаллизации.
Еще одной причиной кристаллизации и плавления является изменение давления. На некоторые вещества давление может оказывать значительное влияние, в результате чего температура плавления или кристаллизации может меняться. Например, при повышении давления на твердое вещество, его температура плавления может снизиться, что наблюдается, например, у льда. Влияние давления на плавление и кристаллизацию может быть сложным и зависит от особенностей каждого конкретного вещества.
Кроме того, химический состав вещества может также влиять на его температуру плавления и кристаллизации. Например, добавление примесей к веществу может изменить его свойства и привести к снижению температуры плавления или кристаллизации. Этот эффект широко используется в промышленности, например, при создании сплавов с желаемыми температурами плавления и кристаллизации.
Все эти причины кристаллизации и плавления веществ позволяют понять, как происходят эти фазовые переходы и как можно контролировать температуры плавления и кристаллизации различных материалов.
Кристаллизация вещества
Кристаллическая структура вещества формируется благодаря упорядоченному расположению его атомов, ионов или молекул в пространстве. В результате кристаллизации образуются характерные для каждого вещества кристаллы – однородные структуры, обладающие определенной геометрической формой. Кристаллы могут быть различной величины и формы, их свойства зависят от вида и структуры вещества.
Кристаллизация происходит, когда вещество охлаждается до определенной температуры, называемой точкой кристаллизации. При достижении этой температуры, движение молекул или ионов замедляется, что позволяет им располагаться в определенном порядке и формировать кристаллическую структуру. Кристаллы могут образовываться как на поверхности жидкости, так и внутри ее объема.
Кристаллизация важна как в научных исследованиях, так и в промышленных процессах. Она используется для получения различных веществ, таких как сахар, соль, лекарственные препараты и др. Кристаллическая форма вещества имеет большое значение для их свойств и применений. Например, фармацевтические препараты, имеющие кристаллическую структуру, обладают определенными растворимостью и эффективностью. Кристаллизация также играет важную роль в материаловедении, где изучается влияние структуры кристаллов на свойства различных материалов.
Таким образом, кристаллизация вещества – это сложный и важный процесс, который определяет его свойства и способность принимать определенную форму. Изучение кристаллизации помогает лучше понять множество физических и химических явлений и применить их в практических целях.
Влияние температуры
Температура играет важную роль в процессах кристаллизации и плавления веществ. При повышении температуры молекулы вещества получают больше энергии, что приводит к увеличению движения частиц и, следовательно, увеличению их средней скорости. Это делает кристаллы менее стабильными, и они начинают растворяться.
Изменение температуры также меняет тепловое движение молекул вещества. При понижении температуры тепловое движение замедляется, и молекулы могут организоваться в более упорядоченные структуры – кристаллы.
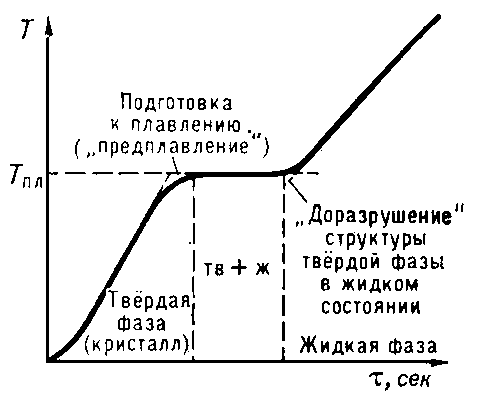
Температура точки плавления является критическим значением. При повышении температуры выше этой точки, вещество переходит из твердого состояния в жидкое состояние, а при понижении оно затвердевает. Это связано с тем, что при достижении точки плавления силы притяжения между молекулами перестают превалировать над их движением, и вещество начинает плавиться.
Один из примеров влияния температуры на кристаллизацию и плавление – лед и вода. Лед образуется при замерзании воды при понижении температуры до 0 градусов по Цельсию. При повышении температуры до этой точки, лед тает, превращаясь в воду. Температура влияет на скорость перехода льда в воду — чем выше температура, тем быстрее происходит плавление.
Структурные изменения
При изменении температуры вещества возможны структурные изменения, которые могут приводить к кристаллизации или плавлению вещества.
Когда температура вещества падает ниже его плавовой точки, происходит кристаллизация, это процесс, при котором молекулы вещества сближаются и формируют упорядоченную кристаллическую структуру. Кристаллические структуры обладают регулярным расположением молекул и определенными свойствами, такими как жесткость, прозрачность и оптическая активность.
С другой стороны, когда температура вещества превышает его плавовую точку, происходит плавление, это процесс, при котором упорядоченная кристаллическая структура разрушается и молекулы вещества становятся более подвижными. Плавленые вещества обладают более свободной структурой, что позволяет им принимать форму контейнера, в котором они находятся.
Структурные изменения, связанные с кристаллизацией и плавлением, важны для понимания свойств веществ и их применения в различных областях, включая материаловедение, физику и химию. Исследование этих процессов помогает улучшить производство материалов и разрабатывать новые технологии с применением кристаллических и плавленых веществ.
| Процесс | Плавление (кристаллизация) |
|---|---|
| Температура | Повышение (понижение) |
| Структура | Кристаллическая (подвижная) |
| Свойства | Жесткость, прозрачность (более свободная структура) |
Плавление вещества
При повышении температуры молекулы вещества получают больше энергии и начинают двигаться более активно. При достижении определенной критической температуры, называемой температурой плавления, молекулы разрушают силы притяжения, которые держат их в твердом состоянии, и вещество становится жидким.
В процессе плавления, теплота, которая подается к веществу, используется для преодоления сил притяжения между молекулами. Поэтому процесс плавления является эндотермическим, то есть требует поглощения теплоты. Это означает, что во время плавления температура вещества не повышается, а остается постоянной, пока все молекулы не пройдут процесс перехода в жидкое состояние.
Температура плавления может зависеть от различных факторов, таких как давление и наличие примесей. Именно поэтому для определения точной температуры плавления вещества необходимо держать эти факторы постоянными. Некоторые вещества могут иметь очень низкую температуру плавления, например, ртуть плавится при -38,87 градуса Цельсия, в то время как другие вещества могут иметь очень высокую температуру плавления, например, кварц плавится при 1713 градуса Цельсия.
Важным свойством плавления является то, что при повышении температуры вещество сохраняет свою химическую природу и состав. Плавление – это физический процесс, а не химическая реакция. Это позволяет использовать процесс плавления для различных технологических целей, например, для получения металлов из руд или для переработки пластмасс.
Энергия и тепло

Кристаллизация происходит, когда вещество получает достаточное количество энергии, чтобы молекулы или атомы выстроились в упорядоченную решетку. В процессе кристаллизации теряется теплота среды как молекулы или атомы вещества становятся более упорядоченными и менее подвижными.
С другой стороны, плавление происходит, когда вещество получает достаточно тепла для того, чтобы частицы стали достаточно подвижными, чтобы сломить упорядоченность и силы притяжения вещества. В процессе плавления поглощается теплота окружающей среды.
Энергия и тепло, поступающие в вещество, являются ключевыми факторами для изменения агрегатного состояния веществ. Они играют важную роль в процессе кристаллизации и плавления, определяя, на какой температуре эти изменения начинаются и заканчиваются.
Энергия и тепло – неотъемлемые компоненты процессов изменения агрегатного состояния веществ и могут варьироваться в зависимости от химической природы вещества и окружающих условий.
Межмолекулярные силы
Существует несколько типов межмолекулярных сил, каждый из которых оказывает различное влияние на кристаллизацию и плавление веществ. Ван-дер-Ваальсовы силы, дисперсионные силы и диполь-дипольные взаимодействия являются самыми распространенными видами межмолекулярных сил.
Ван-дер-Ваальсовы силы, или слабые дипольные-дипольные взаимодействия, возникают из-за временного несимметрии электронной оболочки молекулы. При этом возникает слабый диполь. Взаимодействие между такими слабыми диполями и создает притяжение между молекулами.
Дисперсионные силы, также известные как мгновенные диполи, возникают из-за временного возникновения неравномерного распределения электронной плотности внутри молекулы. Это приводит к образованию временного диполя и, как следствие, к притяжению между молекулами.
Диполь-дипольные взаимодействия возникают между молекулами, имеющими постоянные дипольные моменты. При таких взаимодействиях положительный конец одной молекулы притягивает отрицательный конец другой молекулы, что создает притяжение между ними.
Именно межмолекулярные силы определяют температуру плавления и кристаллизации вещества. При достижении определенной температуры межмолекулярные силы побеждают тепловое движение молекул, что приводит к плавлению вещества. При снижении температуры межмолекулярные силы становятся достаточно сильными, чтобы преодолеть энергию теплового движения и создать регулярную структуру, что приводит к образованию кристаллов.