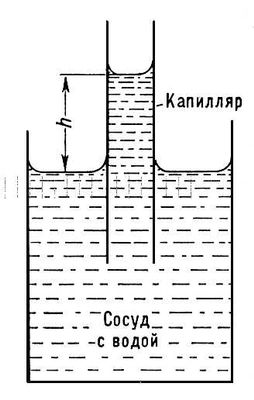
Капиллярное действие – это довольно удивительное явление, которое можно наблюдать, например, когда смачивающая жидкость начинает подниматься в тонкой трубке, которую мы называем капилляром. Интересно, что эта подъемная сила преодолевает силу тяжести и приводит к появлению вогнутого мениска. Но почему жидкость смачивает именно в этом виде?
Для начала стоит отметить, что поверхность тонкой трубки обладает свойством адгезии, то есть притягивает молекулы жидкости к себе. При этом внутри капилляра действует сила когезии, которая связывает молекулы друг с другом. Именно эти две силы – адгезия и когезия – взаимодействуют и определяют форму, которую принимает смачивающая жидкость.
Когда смачивающая жидкость попадает в капилляр, адгезия привлекает жидкость к поверхности капилляра, в то время как когезия сохраняет ее целостность, не позволяя распространиться по боковым стенкам. В результате такого баланса сил, смачивающая жидкость принимает вогнутую форму, при которой ее поверхность имеет меньшую кривизну в сравнении с поверхностью свободной жидкости.
Физические принципы
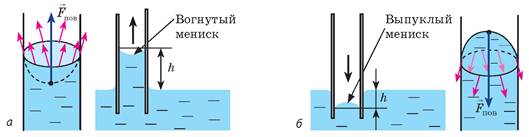
- Поверхностное натяжение: Смачивающая жидкость обладает поверхностным натяжением, которое приводит к образованию поверхностного слоя молекул на границе раздела с жидкостью.
- Когезия: Молекулы смачивающей жидкости сильно взаимодействуют друг с другом, что создает устойчивость молекулярного слоя на поверхности.
- Адгезия: Молекулы смачивающей жидкости также взаимодействуют с поверхностью материала, из которого состоит капилляр. Это взаимодействие определяет форму мениска внутри капилляра.
При наличии этих физических свойств, смачивающая жидкость образует вогнутый мениск в капиллярах. Вогнутая форма мениска происходит из-за баланса между силами поверхностного натяжения и адгезии жидкости к стенкам капилляра.
Капиллярное давление
При взаимодействии смачивающей жидкости с поверхностью капилляра происходит уравновешивание сил внутри и снаружи капилляра. На стенках капилляра действует сила притяжения молекул жидкости, которая стремится сократить свободную поверхностную энергию системы. В результате молекулы жидкости в смачивающей жидкости оказываются прижатыми к стенкам капилляров и образуют вогнутый мениск.
Возникновение вогнутого мениска приводит к появлению дополнительного давления внутри капилляра, которое называется капиллярным давлением. Чем меньше радиус капилляра, тем больше будет капиллярное давление. Также, капиллярное давление зависит от уровней смачивания жидкости и свойств поверхности капилляра.
Капиллярное давление имеет большое значение в различных физических явлениях и процессах, таких как поднятие воды в растениях, капиллярное подъемничество, проникновение жидкостей в пористые материалы и многое другое.
Поверхностное натяжение

При поверхностном натяжении молекулы жидкости в верхнем слое сильно притягиваются друг к другу, образуя некую «пленку» на поверхности. Это приводит к кривизне поверхности и образованию вогнутого мениска в капиллярах.
В результате поверхностного натяжения капля жидкости принимает сферическую форму, так как это форма, которая имеет наименьшую поверхностную энергию. В капиллярах же, где контакт с внешней средой ограничен, жидкость образует вогнутый мениск, чтобы уменьшить свою поверхностную энергию.
Вогнутый мениск в капиллярах можно объяснить с помощью явления капиллярности. Когда жидкость находится в капилляре, адгезионные силы между жидкостью и стенками капилляра преобладают над когезионными силами внутри жидкости. Это создает дополнительное поверхностное натяжение на верхней поверхности жидкости и приводит к образованию вогнутого мениска.
Капиллярное явление и кравитация

Кравитация – это сила притяжения, которую испытывают все тела с массой. Сила гравитации пропорциональна массе тела и обратно пропорциональна квадрату расстояния между ними.
Влияние кравитации на капилляры объясняет вогнутый мениск, который образуется внутри них. Если не учитывать гравитационные силы, молекулы смачивающей жидкости будут равномерно распределены внутри капилляра. Однако, под действием кравитации, на верхние слои молекул уровня станут действовать силы притяжения, направленные вниз, а на нижние слои – силы притяжения, направленные вверх.
Как результат, слои молекул смачивающей жидкости смещаются вниз, в зону меньшего давления. Это создает вогнутый мениск, поскольку из-за смещения частиц вниз, уровень жидкости возрастает на краях капилляра. Такое поведение капиллярной жидкости находит свое применение во многих физических и биологических процессах, как, например, растущие растения транспортируют воду под действием капиллярных сил.
Важно отметить, что на мениск силы кравитации влияют на силы когесия и адгезии (силы, связанные с взаимодействием молекул внутри жидкости и на границе раздела двух фаз).
Взаимодействие с капилляром

Межмолекулярные силы являются главной причиной образования вогнутого мениска. Сущность этих сил заключается в следующем: молекулы смачивающей жидкости сами по себе обладают тенденцией смачивать поверхности, которые имеют повышенную адгезию. Адгезия — это силовое взаимодействие между различными веществами, когда их поверхности контактируют друг с другом.
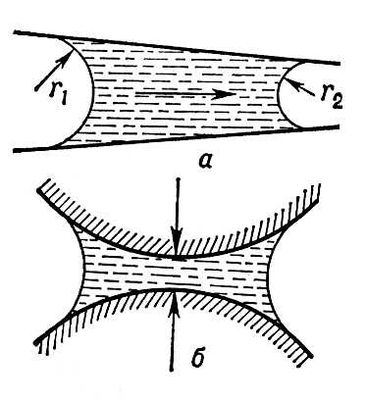
В случае капилляра, поверхность которого хорошо смачивается смачивающей жидкостью, адгезия приводит к тому, что молекулы жидкости вытягиваются вверх, в пределы капилляра и образуют вогнутый мениск. В результате этого образуются два участка мениска с разными радиусами кривизны — внутренний и внешний.
Внутренний радиус кривизны является положительным, так как он измеряется внутри мениска. Он связан с адгезией между жидкостью и поверхностью капилляра. Внешний радиус кривизны является отрицательным и связан с коэрцией между молекулами смачивающей жидкости.
| Внутренний радиус кривизны | Внешний радиус кривизны |
|---|---|
| Положительный | Отрицательный |
Из-за разности этих радиусов возникает внутреннее напряжение, которое притягивает жидкость к поверхности капилляра, и деформирует мениск, делая его вогнутым.
Таким образом, взаимодействие с капилляром приводит к образованию вогнутого мениска смачивающей жидкости. Это обусловлено межмолекулярными силами и физическими свойствами как самих молекул жидкости, так и поверхности капилляра.
Молекулярные силы

Вода и другие смачивающие жидкости обладают свойством образовывать в капиллярах вогнутый мениск. Это явление связано с действием молекулярных сил. Молекулы жидкости притягиваются друг к другу силами ван-дер-Ваальса, дисперсионными силами и силами адгезии.
Силы ван-дер-Ваальса возникают из-за временного несимметричного расположения электронов в атомах или молекулах. В результате таких временных несимметрий между невзаимодействующими молекулами образуются слабые привлекательные силы. Вода и другие смачивающие жидкости обладают дипольными моментами, что усиливает ван-дер-Ваальсовы силы притяжения.
Дисперсионные силы возникают из-за непостоянства электронной оболочки атомов или молекул. При сближении молекул смачивающей жидкости и поверхности капилляра электроны атомов или молекул на короткое время собираются на одной стороне, создавая электронный диполь. В результате возникают временные волны любого знака, что приводит к силам притяжения между молекулами смачивающей жидкости и поверхностью капилляра.
Силы адгезии возникают из-за электростатического притяжения между заряженными частичками молекул смачивающей жидкости и поверхностью капилляра. Например, вода обладает электростатическим притяжением к положительным и отталкиванием от отрицательных зарядов. В результате возникают притягивающие силы между водой и поверхностью капилляра.
| Молекулярные силы | Примеры жидкостей |
|---|---|
| Ван-дер-Ваальсовы силы | Вода, этиловый спирт |
| Дисперсионные силы | Масло, бензин |
| Силы адгезии | Вода, молоко |
Угол смачивания
Угол смачивания определяется как угол между поверхностью твердого тела и касательной, проведенной к поверхности в точке контакта смачивающей жидкости. Если угол смачивания меньше 90 градусов, то жидкость полностью смачивает поверхность твердого тела. В этом случае смачивающая жидкость равномерно распределяется по поверхности и проникает в поры или капилляры, образуя выпуклый мениск.
Однако если угол смачивания больше 90 градусов, то жидкость не может полностью смачивать поверхность. В этом случае смачивающая жидкость образует вогнутый мениск внутри капилляра. Это объясняется доминированием сил межмолекулярного взаимодействия в твердом теле и сил поверхностного натяжения в жидкости.
Угол смачивания также зависит от свойств поверхности твердого тела и химической природы жидкости. Например, гладкая и чистая поверхность обычно лучше смачивается жидкостью, чем шероховатая или загрязненная поверхность.
Угол смачивания является важным параметром для понимания взаимодействия жидкостей с твердыми поверхностями, и он находит применение в различных областях, таких как материаловедение, химия и биология.