Азот и углерод — это два химических элемента, которые относятся к неметаллам в периодической системе химических элементов. Однако, свойства этих элементов значительно различаются. Азот обладает более выраженными неметаллическими свойствами в сравнении с углеродом.
Одной из причин, по которой азот обладает более выраженными неметаллическими свойствами, является его электроотрицательность. Азот имеет более высокую электроотрицательность по сравнению с углеродом, что делает его более способным привлекать электроны к себе. Это объясняет его способность образовывать стабильные ковалентные связи с другими элементами и соединениями.
Кроме того, азот обладает более высокой энергией ионизации, что делает его более склонным к образованию отрицательных ионов. Это также влияет на его свойства и его способность реагировать с другими элементами и соединениями.
Углерод, в свою очередь, обладает более металлическими свойствами. Углерод имеет способность образовывать множество различных соединений, благодаря своей способности образовывать четыре ковалентные связи. Это позволяет углероду создавать разнообразные структуры, такие как углеродные цепи, кольца и трехмерные структуры. В результате углерод формирует различные типы соединений, включая органические соединения и углеродные материалы.
Азот и углерод: особенности неметаллических свойств
Азот имеет атомный номер 7 и электронную конфигурацию 1s22s22p3. У него есть пять электронов в внешней электронной оболочке, что делает его электроотрицательным элементом. Азот образует прочные тройные ковалентные связи с другими атомами азота, образуя молекулу N2. Это делает азот стабильным и инертным газом при комнатной температуре и давлении.
Углерод имеет атомный номер 6 и электронную конфигурацию 1s22s22p2. В его внешней электронной оболочке находятся четыре электрона, что позволяет углероду образовывать четыре ковалентные связи. Углерод является основным строительным блоком органических соединений, таких как углеводороды, аминокислоты и жиры.
| Азот | Углерод |
|---|---|
| Высокая электроотрицательность | Умеренная электроотрицательность |
| Образует молекулу N2 | Образует разнообразные органические соединения |
| Инертный газ при комнатной температуре и давлении | Важный элемент в органической химии |
Таким образом, азот и углерод имеют различия в своей электронной структуре и способности образовывать химические связи, что определяет их различные неметаллические свойства.
Азот: более выраженные неметаллические свойства
Атом азота имеет электронную конфигурацию 1s2 2s2 2p3. В его внешнем энергетическом уровне находятся пять электронов, что делает его очень электроотрицательным элементом. Азот имеет недостаток в одном электроне, чтобы заполнить полностью его внешний энергетический уровень и достичь стабильной конфигурации.
Из-за этого, азот проявляет высокую химическую активность и склонность к образованию химических связей с другими элементами. Азот может образовывать мощные ковалентные связи с различными атомами, такими как водород, кислород и металлы.
Кроме того, азот обладает способностью образовывать двойные и тройные связи, благодаря чему он может образовывать сложные органические соединения. Например, азот может образовывать тройную связь с другим азотом, образуя азотистые основания. Это свойство делает азот важным элементом для жизни, так как он является составной частью ДНК, РНК и белков — основных молекул, отвечающих за передачу наследственной информации и функционирование клеток.
Таким образом, азот обладает более выраженными неметаллическими свойствами, чем углерод, благодаря особенностям его электронной структуры и способности образовывать различные типы химических связей с другими элементами.
Точка кипения и плавления
Точка кипения — это температура, при которой жидкость переходит в газовое состояние при определенном давлении. Точка плавления — это температура, при которой вещество переходит из твердого состояния в жидкое состояние. Для азота и углерода эти значения различаются.
Азот имеет довольно низкую точку кипения, равную -196 °C, и низкую точку плавления, равную -210 °C. Это означает, что при комнатной температуре и атмосферном давлении, азот находится в газообразном состоянии. Он не образует твердых кристаллических структур, как многие другие неметаллы.
Углерод, с другой стороны, имеет гораздо более высокие значения точки кипения и плавления. Точка кипения углерода составляет 4827 °C, а точка плавления — 3550 °C. Таким образом, углерод обычно находится в твердом состоянии при комнатной температуре и атмосферном давлении. Он образует различные кристаллические формы, такие как алмаз и графит.
Это различие в точках кипения и плавления указывает на более неметаллический характер азота по сравнению с углеродом. Возможно, это связано с различиями во внутренней структуре и связях между атомами в молекулах этих элементов.
Химическая активность
Азот имеет электронную конфигурацию [He]2s22p3, что означает, что в его внешней оболочке находятся 5 электронов. Азот стремится заполнить свою внешнюю оболочку, чтобы достичь стабильности. Для этого атом азота образует тройные связи с другими атомами, образуя молекулы азота (N2).
Углерод имеет электронную конфигурацию [He]2s22p2, что означает, что в его внешней оболочке находятся 4 электрона. Углерод может образовывать множество различных соединений, так как он способен образовывать четыре ковалентные связи. Это позволяет углероду образовывать длинные цепочки и кольца, что делает его основным строительным элементом органических соединений.
Однако, азот обладает более выраженными неметаллическими свойствами по сравнению с углеродом. Это связано с его более высокой электроотрицательностью. Азот более сильно притягивает электроны, что делает его более реакционноспособным. Азот образует различные соединения с другими элементами, такие как аммиак (NH3) и нитраты (NO3—), что подтверждает его высокую химическую активность.
Углерод: менее выраженные неметаллические свойства
Во-первых, углерод образует четыре связи с другими атомами, что позволяет ему образовывать длинные цепочки, кольца и трехмерные структуры. Это делает углерод основным элементом органической химии, где молекулы могут быть очень сложными и разнообразными.
Кроме того, углерод обладает способностью образовывать двойные и тройные связи с другими атомами, что позволяет образовывать насыщенные и ненасыщенные соединения. Двойные и тройные связи между атомами углерода и другими элементами придают молекулам особые свойства, такие как устойчивость и реакционную способность.
Углерод также имеет способность образовывать положительные и отрицательные ионы, в зависимости от количества позитивных и негативных зарядов в его внешней оболочке электронов. Это делает углерод особенно важным элементом в химии и биологии, где он участвует в реакциях и образует основу для многих органических соединений.
Таким образом, углерод обладает менее выраженными неметаллическими свойствами, чем азот, ввиду его способности образовывать сложные структуры, иметь различные типы связей с другими атомами и образовывать ионы. Эти свойства делают его основой органической химии и дают углероду большое значение в нашей жизни.
Твердые аллотропные модификации
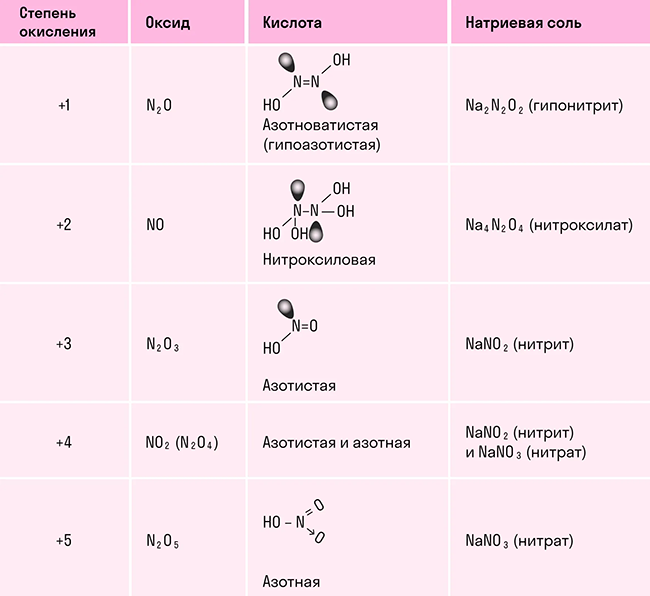
У азота существует две основные аллотропные модификации – молекулярный азот (N2) и аморфный азот. Молекулярный азот представляет собой двухатомные молекулы, связанные тройной ковалентной связью. Этот вид азота обладает низкой реакционной способностью и служит основным компонентом воздуха, составляя около 78% его объема.
Аморфный азот жидкий или твердый азот, полученный при очень низких температурах. Он отличается от молекулярного азота тем, что его молекулы находятся в более хаотичном состоянии. Аморфный азот обладает необычными свойствами, такими как низкая теплопроводность и высокая электросопротивляемость.
Углерод также имеет несколько аллотропных модификаций, самой известной из них является графит. Графит представляет собой слоистую структуру углерода, в которой атомы связаны слабыми силами в плоскости, но сильно связаны внутри плоскостей. Это обеспечивает графиту некоторые металлические свойства, такие как проводимость электричества и тепла.
Однако, в отличие от азота, углерод также имеет другие аллотропные модификации, такие как алмаз и аморфный углерод. Алмаз – это кристаллическая структура углерода, в которой атомы связаны ковалентными связями, образуя трехмерную решетку. Алмаз обладает высокой твердостью, прозрачностью и излучает блеск при слабом освещении.
Аморфный углерод – это неупорядоченная структура углерода, полученная при высоких температурах и давлениях. Он может иметь различные формы, такие как сажа или уголь. Аморфный углерод обладает низкой проводимостью электричества и тепла.
Таким образом, хотя азот и углерод оба являются неметаллами, азот имеет более выраженные неметаллические свойства из-за своих аллотропных модификаций, таких как молекулярный азот и аморфный азот.
Способность к образованию связей

С одной стороны, азот и углерод оба относятся к группе неметаллов и обладают способностью образовывать связи с другими элементами. Однако, азот обладает более выраженной способностью к образованию связей, по сравнению с углеродом.
Азот имеет электронную конфигурацию 1s2 2s2 2p3, что означает, что его внешний электронный слой содержит три электрона. Углерод имеет электронную конфигурацию 1s2 2s2 2p2, что означает, что его внешний электронный слой содержит четыре электрона.
Из-за этого различия в количестве внешних электронов, азот более агрессивно и быстро образует связи с другими элементами. Азот имеет высокую электроотрицательность и проявляет тенденцию к образованию тройных связей, что делает его очень реактивным. Углерод, в свою очередь, образует связи, основываясь на способности обоих его пустых p-орбиталей к предоставлению электронов для образования связей.
Из-за этой разницы в способности к образованию связей, азот часто используется как атрибут реакции, катализатор или образует структурные элементы в органических соединениях. Углерод, в свою очередь, обладает уникальной способностью образования длинных и разветвленных цепей, что делает его основным строительным элементом органических соединений, таких как углеводороды и белки.
