Перенос вещества в растворах электролитов является важным исследовательским вопросом в области химии и электрохимии. При прохождении электрического тока через раствор электролита происходит перемещение ионов, а также частичек растворенного вещества. Это связано с наличием в растворе заряженных частиц — ионов, которые перемещаются под влиянием электрического поля, возникающего в процессе электролиза.
Перенос вещества в растворах электролитов может быть вызван разными причинами. Во-первых, это может быть связано с действием электрического поля на заряженные частицы — ионы. Под воздействием поля ионы начинают двигаться в определенном направлении, образуя электрический ток. Во-вторых, перенос вещества может происходить под действием концентрационного градиента. Есть вещества, которые сами по себе не являются ионами, но при действии электрического поля разлагаются на заряженные ионы, что также вызывает перенос вещества.
Механизмы переноса вещества при прохождении тока через раствор электролита включают несколько процессов. Главными из них являются диффузия и электрофорез. Диффузия — это процесс перемешивания и распределения частиц в растворе под воздействием теплового движения. В случае электролитического раствора диффузия происходит не только из-за теплового движения, но и под влиянием электрического поля. Электрофорез — это перемещение заряженных частиц под действием электрического поля. Оба эти механизма вместе обеспечивают перенос вещества при прохождении электрического тока через раствор электролита.
Перенос вещества при прохождении тока через раствор электролита
В процессе прохождения электрического тока через раствор электролита происходит явление переноса вещества. Этот процесс вызван движением ионов под влиянием электрического поля, создаваемого приложенным напряжением.
Перенос вещества осуществляется за счет двух основных механизмов: диффузии и электрофореза.
Диффузия – это процесс перемещения частиц из области с более высокой концентрацией в область с более низкой концентрацией. В растворе электролита ионы, включенные в состав электролита, подвергаются диффузии. Диффузия ионов приводит к равномерному распределению вещества в объеме раствора.
Электрофорез – это движение заряженных частиц под влиянием электрического поля. Заряженные ионы в растворе электролита подвергаются силе электрического поля, которая толкает их в направлении, противоположном заряду. В результате этого происходит перенос ионов к электроду с противоположным зарядом.
Кроме диффузии и электрофореза, перенос вещества в растворе электролита также может быть вызван конвекцией – образованием конвекционных потоков в растворе под влиянием приложенного электрического поля. Конвекция способна усиливать процессы диффузии и электрофореза, влияя на скорость переноса вещества.
Важно отметить, что процессы переноса вещества в растворе электролита являются взаимосвязанными и влияют друг на друга. Эти процессы играют важную роль в различных физико-химических процессах, таких как электрохимические реакции, электрофорез, электролиз.
Главные причины переноса вещества
Перенос вещества при прохождении тока через раствор электролита обусловлен действием нескольких основных причин, включая:
| Электростатическое взаимодействие | – электрическое поле в растворе электролита вызывает перемещение ионов соответствующих зарядов в определенном направлении. |
| Диффузия | – движение частиц вещества под влиянием разницы их концентраций. |
| Электрофорез | – движение частиц под воздействием силы Кулона, вызванное разницей электрических зарядов. |
| Электроосмос | – движение растворителя в пористой среде под влиянием электрического поля. |
Эти причины взаимодействуют друг с другом и могут влиять на скорость и направление переноса вещества в растворе электролита.
Ионная диссоциация раствора

Этот процесс особенно характерен для солей, кислот и щелочей. При диссоциации солевых соединений, например хлорида натрия (NaCl), молекула NaCl разделяется на ионы натрия (Na+) и хлорида (Cl-). Таким образом, раствор NaCl содержит свободно движущиеся ионы Na+ и Cl-, которые могут перемещаться при прохождении электрического тока через раствор.
Ионная диссоциация играет важную роль в объяснении переноса вещества при прохождении тока через раствор электролита. Ионы, обладающие зарядом, могут двигаться под воздействием электрического поля, что приводит к образованию электрического тока. Кроме того, диссоциация раствора влияет на проводимость электролита — чем больше ионов образуется при диссоциации, тем выше проводимость раствора.
Поляризация электролита
Одним из основных процессов при поляризации электролита является процесс десорбции и адсорбции заряженных ионов. При прохождении тока через электролит ионы перемещаются к электродам, где происходит их десорбция и адсорбция. Десорбция – это процесс высвобождения ионов из электрического двойного слоя на поверхности электрода в раствор электролита. Адсорбция – это обратный процесс, при котором ионы адсорбируются на поверхности электрода.
Еще одним процессом, способствующим поляризации электролита, является электролитическая диссоциация. Под воздействием электрического тока некоторые молекулы электролита распадаются на ионы с разными зарядами. Это приводит к образованию ионов разных зарядов в растворе, что способствует образованию электрического двойного слоя.
Поляризация электролита можно наблюдать во многих электрохимических процессах, таких как электролиз, гальванические элементы и аккумуляторы. Она играет важную роль в электрохимии и имеет применение в различных сферах, включая электрохимические синтезы и аналитические методы исследования.
Механизмы переноса вещества

Перенос вещества при прохождении тока через раствор электролита осуществляется по разным механизмам.
Одним из основных механизмов переноса вещества является ионная диффузия. В этом случае ионы электролита перемещаются из области с более высокой концентрацией в область с более низкой концентрацией. Диффузия происходит под влиянием теплового движения ионов.
Еще одним способом переноса вещества является электродиффузия. В этом случае перенос происходит под воздействием электрического поля, создаваемого при прохождении тока через электролит. Электрическое поле оказывает влияние на движение заряженных частиц, ускоряя их перемещение.
Также существует механизм массового переноса, когда жидкость с веществом перемещается под воздействием градиента давления или других факторов. В этом случае перенос вещества происходит не только за счет диффузии и электрического поля, но и за счет самого движения жидкости.
Важно отметить, что все эти механизмы переноса вещества могут взаимодействовать и действовать одновременно при прохождении тока через электролит. Их вклад в общий процесс переноса будет зависеть от условий и свойств электролита.
Диффузия

Диффузия происходит под влиянием термодинамического закона второго рода, согласно которому в системе всегда происходит стремление к равномерному распределению вещества. Таким образом, при наличии градиента концентрации электролита, молекулы будут перемещаться из области более высокой концентрации в область более низкой концентрации, чтобы достичь равновесия.
Диффузия играет важную роль в растворах электролитов, поскольку приводит к переносу заряженных и незаряженных частиц. Заряженные ионы диффундируют в растворе под влиянием электрических сил, возникающих на границах раздела разных концентраций. Незаряженные частицы, такие как молекулы воды или других растворителей, также могут диффундировать.
Механизм диффузии имеет важное значение для понимания процессов переноса в электролитах и используется во многих научных и технологических приложениях, включая биологические и химические процессы.
Электрофорез
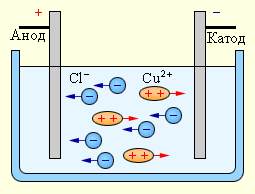
При прохождении постоянного тока через раствор электролита, заряженные частицы начинают двигаться под влиянием силы электростатического притяжения или отталкивания, в зависимости от их заряда.
Механизм электрофореза основан на явлении электроосмоса, когда наличие электрического поля вызывает движение раствора электролита вокруг заряженных частиц.
Это явление происходит из-за появления разницы электрического потенциала между поверхностью частиц и раствором, что приводит к деформации оболочки двойного слоя и перераспределению зарядов на поверхности частиц.
Применение электрофореза широко используется в биохимических и медицинских исследованиях для разделения и анализа белков, нуклеиновых кислот и других биологических молекул.
Также электрофорез применяется в промышленности для очистки сточных вод и получения различных продуктов, таких как лекарственные препараты и косметические средства.
Виды электрофореза включают горизонтальный (планарный) и вертикальный электрофорез.
В горизонтальном электрофорезе образец помещается на поверхность геля, а электроды размещаются на краю геля.
В вертикальном электрофорезе образец наносится на край геля, а электроды располагаются сверху и снизу геля.
Заключение
Электрофорез является эффективным методом разделения и анализа заряженных частиц в растворе электролита.
Механизм электрофореза основан на электростатическом притяжении или отталкивании заряженных частиц в электрическом поле.
Этот метод имеет широкое применение в научных и промышленных сферах.