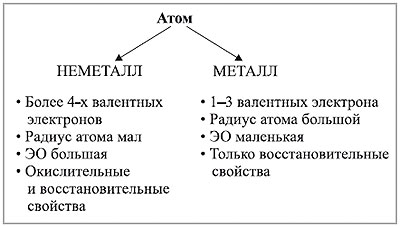
Неметаллы – это элементы, которые не обладают свойствами металлов, такими как блеск, проводимость электричества и тепла. Они являются основными строительными блоками органического мира, присутствуют во многих живых организмах и имеют огромное значение для человеческой жизни. Неметаллы могут проявлять различные химические свойства, в том числе окислительные и восстановительные.
Окислительные свойства неметаллов проявляются в их способности принимать электроны от других веществ. При этом они сами становятся веществами, набирающими положительный заряд (оксидами). Окисление – это процесс, при котором атомы неметаллов увеличивают свою степень окисления путем потери электронов.
Восстановительные свойства неметаллов проявляются в их способности отдавать электроны другим веществам и тем самым уменьшать свою степень окисления. Восстановление – это процесс, при котором атомы неметаллов увеличивают свою степень восстановления путем приобретения электронов.
Примеры окислительных свойств неметаллов: хлор (Cl), фтор (F), кислород (O). Хлор и фтор могут вступать в реакцию с металлами, отбирая у них электроны, и образуя ионы хлорида и фторида соответственно. Кислород, например, окисляется при взаимодействии с водородом, образуя молекулу воды.
Примеры восстановительных свойств неметаллов: карбон (C), сера (S), азот (N). Карбон может реагировать с кислородом, отдавая ему электроны и образуя оксид углерода. Сера при окислении взаимодействует с медью, отдавая ей электроны и образуя сульфид меди. Азот может вступать в реакцию с водородом, образуя аммиак и отдавая электроны.
- Неметаллы: окислительные и восстановительные свойства
- Что такое окислительные и восстановительные свойства неметаллов?
- Определение окислительных свойств неметаллов
- Определение восстановительных свойств неметаллов
- Примеры окислительных и восстановительных свойств неметаллов
- Примеры окислительных свойств
- Примеры восстановительных свойств
Неметаллы: окислительные и восстановительные свойства
Неметаллы представляют собой класс элементов, которые обладают отрицательным электрохимическим потенциалом и обычно не образуют положительно заряженных ионов в растворе. Эти элементы могут проявлять как окислительные, так и восстановительные свойства в химических реакциях.
Окислительные свойства неметаллов проявляются в том, что они способны принимать электроны от других веществ при окислительно-восстановительных реакциях. Они обычно имеют высокую электроотрицательность и стремятся к электронному заполнению внешней электронной оболочки. Примерами неметаллов с окислительными свойствами являются хлор, бром, йод и флуор.
Восстановительные свойства неметаллов проявляются в способности этих элементов отдавать электроны другим веществам в химических реакциях. При взаимодействии с веществами, имеющими большее положительное электрохимическое потенциал, неметаллы способны передавать свои электроны, что позволяет им выступать в роли восстановителя. Например, сера и фосфор обладают восстановительными свойствами.
Основные реакции, в которых неметаллы проявляют окислительные и восстановительные свойства, включают окисление, восстановление, а также реакции замещения и гидролиза. Эти свойства неметаллов имеют важное значение в различных областях, включая промышленность, медицину и экологию.
В целом, неметаллы проявляют разнообразные окислительные и восстановительные свойства, которые играют важную роль в химических процессах и реакциях. Изучение этих свойств помогает понять и контролировать химические процессы и применять их в различных областях науки и промышленности.
Что такое окислительные и восстановительные свойства неметаллов?
Окислительные свойства неметаллов проявляются в способности принимать вещества или атомы электронов от других веществ, которые при этом окисляются. Неметаллы, обладающие окислительными свойствами, выступают в реакциях как активные элементы, вызывая процессы окисления у веществ, с которыми взаимодействуют.
В то же время, неметаллы могут обладать и восстановительными свойствами. Восстановительные свойства неметаллов заключаются в их способности отдавать электроны другим веществам или атомам и тем самым восстанавливать их окислительное состояние. В реакциях с неметаллами, обладающими восстановительными свойствами, другие вещества или атомы получают электроны и при этом восстанавливаются.
Примеры окислительных свойств неметаллов:
- Хлор (Cl): окисляет другие вещества, образуя ион хлора с -1 зарядом.
- Фтор (F): проявляет очень сильные окислительные свойства, окисляя другие элементы и образуя ион фторида с -1 зарядом.
- Кислород (O): является одним из наиболее сильных окислителей и способен окислять большинство других элементов.
Примеры восстановительных свойств неметаллов:
- Нитроген (N): обладает амфотерными свойствами и может проявлять и окислительные, и восстановительные свойства.
- Сера (S): может выступать как окислитель, при этом сама восстанавливается.
- Фосфор (P): имеет способность окислять другие вещества и при этом сам восстанавливаться.
Окислительные и восстановительные свойства неметаллов оказывают значительное влияние на их химические реакции и взаимодействие с другими веществами, что делает их важными компонентами в различных процессах и индустрии.
Определение окислительных свойств неметаллов
Окислительные свойства неметаллов определяют их способность принимать электроны от других веществ. При окислении неметалл может увеличивать свою степень окисления.
Окислительные свойства неметаллов обусловлены высокой электроориентацией и их способностью привлекать электроны. Они могут эффективно окислять другие вещества, передавая им электроны и снижая свою степень окисления (превращаясь в ионы).
Примером окислительных свойств неметаллов может служить хлор (Cl). Он способен окислить другие вещества, например, серуридную кислоту (H2SO3), превращая ее в серную кислоту (H2SO4) и принимая два электрона.
Окислительные свойства неметаллов имеют важное практическое значение. Например, хлор используется в химической промышленности для получения различных продуктов, таких как пластмассы и пестициды. Благодаря своим окислительным свойствам хлор может эффективно взаимодействовать с другими веществами и играть ключевую роль в различных процессах.
Определение восстановительных свойств неметаллов
Неметаллы могут проявлять свойства восстановителей, то есть способность передавать электроны другим химическим веществам и принимать на себя положительный заряд. Восстановительные свойства неметаллов обусловлены их электронной структурой и возможностью образованиях химических связей.
Одним из примеров неметалла с выраженными восстановительными свойствами является флуор. Флуор способен непосредственно связываться с такими веществами, как кислород, ионы водорода и металлы. Он может совершать окисление веществ, передавая свои электроны, что позволяет ему взаимодействовать с рядом других элементов и соединений.
Другим примером восстановительных свойств неметаллов является хлор. Хлор также способен связываться с многими элементами и соединениями, проявляя окислительные свойства. В реакциях с веществами, хлор передаёт электроны, изменяя свою электронную конфигурацию и образуя соединения с более низким зарядом.
Таким образом, неметаллы, такие как флуор и хлор, проявляют восстановительные свойства, участвуя в химических реакциях и передавая электроны другим веществам.
Примеры окислительных и восстановительных свойств неметаллов
- Кислород (O2) — является одним из наиболее сильных окислителей. Он способен взаимодействовать с большинством элементов, например, с металлами, тем самым вызывая окисление. Например, при взаимодействии с железом (Fe), образуется ржавчина (Fe2O3).
- Хлор (Cl2) — также проявляет окислительные свойства. Он может окислять некоторые металлы, например, цинк (Zn), образуя хлорид цинка (ZnCl2). Кроме того, хлор способен окислять водород (H2), образуя соляную кислоту (HCl).
- Фтор (F2) — является самым сильным окислителем среди химических элементов. Он способен окислять почти все элементы, включая сам хлор. Например, при взаимодействии с серой (S), образуется гексафторид серы (SF6).
Таким образом, окислительные и восстановительные свойства неметаллов позволяют им взаимодействовать с другими веществами и играть важную роль в химических реакциях.
Примеры окислительных свойств
Некоторые примеры неметаллов с их окислительными свойствами:
- Кислород (O) – один из самых сильных окислителей, способен продуцировать большое количество окислительных реакций. Например, в составе воздуха кислород окисляет железо, образуя ржавчину.
- Хлор (Cl) – также сильный окислитель, участвует во многих окислительных реакциях. Например, хлор может окислить гидроген до хлористого водорода.
- Бром (Br) – подобно хлору, бром имеет высокую окислительную активность. Он окисляет некоторые металлы, например, алюминий.
- Фтор (F) – самый сильный из окислителей. Взаимодействуя с многими веществами, фтор образует сильно окисленные соединения. Например, фтор окисляет серу до гексафторида серы.
- Карбон (C) – окислительные свойства углерода проявляются в его способности соединяться с кислородом в результате горения.
Это только несколько примеров неметаллов с их окислительными свойствами. Неметаллы могут проявлять окислительные свойства в различных реакциях, и их способность окислять зависит от их электроны, структуры атомов и других факторов.
Примеры восстановительных свойств
- Кальций (Ca) восстанавливает оксид железа(III) (Fe2O3), превращая его в железо (Fe) и кальций-оксид (CaO).
- Магний (Mg) восстанавливает оксид алюминия (Al2O3), превращая его в алюминий (Al) и магний-оксид (MgO).
- Цинк (Zn) восстанавливает оксид меди(II) (CuO), превращая его в медь (Cu) и цинк-оксид (ZnO).
- Алюминий (Al) восстанавливает оксид марганца(IV) (MnO2), превращая его в марганец (Mn) и алюминий-оксид (Al2O3).
Это всего лишь несколько примеров восстановительных свойств неметаллов. Каждый из них демонстрирует способность неметалла возвращать элементы к их исходным состояниям путем передачи электронов. Это явление находит широкое применение в различных областях химии и промышленности, таких как производство металлов, электрохимические процессы и производство лекарственных препаратов.